IEC成立于1906年,是世界上最早的国际性电工标准化机构,总部设在日内瓦。1947年ISO成立后,IEC曾作为电工部门并入ISO,但在技术上、财务上仍保持其独立性。根据1976年ISO与IEC的新协议,两组织都是法律上独立的组织,IEC负责有关电工、电子领域的国际标准化工作,其他领域则由ISO负责。
IEC的宗旨是促进电工、电子领域中标准化及有关方面问题的国际合作,增进相互了解。为实现这一目的,出版包括国际标准在内的各种出版物,并希望各国家委员会在其本国条件许可的情况下,使用这些国际标准。IEC的工作领域包括了电力、电子、电信和原子能方面的电工技术。现已制订国际电工标准3000多个。
组织机构
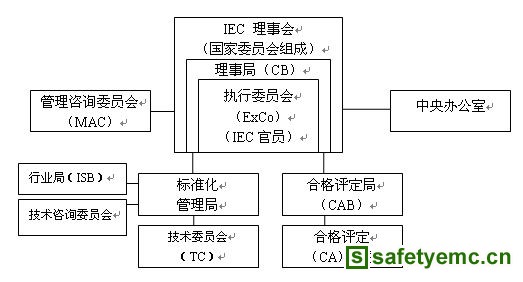
IEC的最高权力机构是理事会。目前有67个成员国,称为IEC国家委员会,每个国家只能有一个机构作为其成员。每个成员国都是理事会成员,理事会会议一年一次,称为IEC年会,轮流在各个成员国召开。 理事会主要官员由现任主席和前任主席、现任副主席、司库、秘书长及各国家委员会代表组成。 理事会负责制定IEC政策和长期战略目标及财政目标;选举理事局、标准管理局及合格评定局成员和主席;修改IEC章程及程序规则等。闭会期间,将所有管理工作委托给理事局,而标准化和合格评定领域的具体管理工作,分别由标准化管理局(SMB)和合格评定委员会(CAB)负责。
理事局(CB)是主持IEC工作的最高决策机构,负责提出并落实理事会制定的政策,由IEC官员和15名由理事会选出的投票成员组成。通常情况下,每年至少召开2次会议。CB负责为理事会会议批准日程和准备文件,接收并审议标准化管理局(SMB)和合格评定局(CAB)的报告。根据需要,可设立咨询机构,并指定咨询机构的主要主席及其成员。
合格评定局(CBA)是一个决策机构,由理事会选举产生的主席、12名投票成员、1名来自IEC合格评定计划的代表、IEC司库和秘书长组成,每年至少召开1次会议。CBA全面管理IEC的合格评定活动,包括批准预算,与其它国际组织就合格评定事项保持联系。
执行委员会(ExCo)执行理事会和理事局的决定,支持中央办公室的运作;监督IEC官员的活动,并负责与IEC国家委员会保持联系;为理事局制定工作日程和起草文件。通常每年召开4次会议。
中央办公室(CO)是IEC的办事机构和活动中心,负责监督IEC章程、技术规范、技术工作导则及理事会和理事局决议的贯彻实施。通过现代化电子手段和通信设备,保证项目管理、工作文件传递和标准最终文本出版发行等各项工作的正常运行。
CO与ISO中央秘书处使用同一个技术工作导则,共同拥有1个信息中心,为各国及各国际组织提供标准化信息服务。
技术委员会(TC)是承担制定、修订工作的技术机构,下设分技术委员会(SC)和项目组(PT)。TC、SC由各成员国自愿参加,主席和秘书经选举产生,由执行委运会任命。
相关的技术委员会
IEC与通信有关的技术委员会主要有:TC1 名词术语;TC3 信息结构、文件和图形符号;TC46 通信和信号传输用电缆、电线、波导、RF连接器和附件;TC48电子设备机电组成和机械结构;TC77 电器设备(包括网络)之间的电磁兼容性;TC81 雷击防护; TC100 音频、视频和多媒体系统与设备;TC103 无线电通信的发射设备;TC 108 视频、音频、信息技术和通信技术领域内的电子设备安全;CISPR 无线电干扰国际特别委员会;ISO/IEC JTC 1 ISO/IEC信息技术联合委员会;ISO/IEC JTC 1/SC 6 系统间电信和信息交换;ISO/IEC JTC 1/SC 25 信息技术设备互连;JTC 1/SC 27 IT安全技术;JTC 1/SC 29 视频、图象、多媒体和超媒体信息的译码;JTC 1/SC 36 学习、教育和培训用信息技术。
IEC对于电磁兼容方面的国际标准化活动有着特殊重要的作用。承担研究工作的主要是电磁兼容咨询委员会(ACEC)、无线电干扰特别委员会(CISPR)和TC77。随着电子技术的飞速发展,IEC拟在电磁兼容方面开展认证工作。

