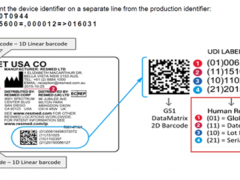
5. 认证证书
5.1认证证书的保持
5.1.1 证书的有效性
本规则覆盖产品的认证证书不规定截止日期。证书的有效性依赖认证机构定期的监督获得保持。
5.1.2认证产品的变更
5.1.2.1变更的申请
获证后的产品,如果其产品中属于附件2或附件3的零部件的规格、型号、生产厂或涉及安全/电磁兼容的设计、电气结构发生变更时,应向认证机构提出变更申请。
5.1.2.2变更评价和批准
认证机构根据变更的内容和提供的资料进行评价,确定是否可以变更或需送样品进行测试,如需送样试验,测试合格后方能进行变更。
5.2认证证书覆盖产品的扩展
5.2.1扩展程序
认证证书持有者需要增加与已经获得认证产品为同一认证单元内的产品认证范围时,应从认证申请开始办理手续,认证机构应核查扩展产品与原认证产品的一致性, 确认原认证结果对扩展产品的有效性,针对差异做补充检测或检查,并根据认证证书持有者的要求单独颁发认证证书或换发认证证书。
5.2.2样品要求
需要送样时,证书持有者应按本规则4.2的要求选送一台样品供认证机构核查。核查后,需对样品进行检测的,检测项目由认证机构决定。
5.3认证证书的暂停、注销和撤消
按《强制性产品认证管理规定》的要求执行。
6. 强制性产品认证标志的使用
证书持有者必须遵守《强制性产品认证标志管理办法》的规定。
6.1准许使用的标志样式
认证涉及电气安全及电磁兼容时,所使用的认证标志为:

认证仅涉及电气安全时,所使用的认证标志为:

6.2变形认证标志的使用
本规则覆盖的产品不允许使用任何形式的变形认证标志。
6.3 加施方式
可以采用国家认监委统一印制的标准规格标志、模压或铭牌印刷三种方式中的任何一种。
6.4标志位置
应在产品本体明显位置上加施认证标志。
7. 收费
认证收费由认证机构按国家有关规定统一收取。
印度尼西亚医疗器械注册要点
印度尼西亚作为东南亚最大的经济体之一,其医疗器械市场近年来展现出强劲的增长势头。印尼的医疗器械市场规模在过去几年中持续扩大,年增长率保持在较高水平。这一增长主要得益于印尼经济的稳定发展、人口的持续增长
0评论2025-05-26162
阿联酋医疗器械注册认证指南
一、基本概况1.自然环境阿拉伯联合酋长国简称阿联酋,位于阿拉伯半岛东部,北濒波斯湾,海岸线长734公里。西和南与沙特阿拉伯交界,东和东北与阿曼毗连。属热带沙漠气候,全年分两季,5至10月为热季,最高气温可达50
0评论2025-05-26137
医疗器械软件注册申报常见问题
问:软件如何进行命名?答:建议在《医疗器械分类目录》《医疗器械通用名称命名规则》和《医用软件通用名称命名指导原则》的框架下,再综合考虑同类已上市产品的名称规范申报注册产品的通用名。问:软件的交付方式有
0评论2024-09-04249
欧盟医疗器械CE注册流程
一、欧盟医疗器械CE注册流程1.你首先需要的是得到一个合格的PRRC(负责法规遵从性的人)。通常由同一个人担任ISO 13485定义的管理者代表。但是,这可以分包给合格的顾问(如CMS)。2.接下来,您需要根据医疗器械法规
0评论2024-09-04164
欧盟发布IVDR延长过渡期的常见问答
2024年7月9日,IVDR过渡期修正案Regulation (EU)2024/1860正式发布。其中更新后第110条讲述了遗留器械的过渡期时限和可以享受过渡期的条件。针对这份延期修正案,欧盟委员会发布了一份《体外诊断医疗器械法规》(IVD
0评论2024-08-09171
欧盟电暖器CE-ErP能效法规更新
法规信息法规名称:(EU) 2024/1103 生效日期:1 July 2025 对象:出口欧盟的电暖器产品主要变化:法规更新取代原法规(EU) 2015/1188更新内容1.管控范围商用局部空间加热器的管控范围由原来的120 kW以下,扩大到300 k
0评论2024-06-18197
浅析欧盟通用充电器的修订指令及指令指导文件
近些年由于ICT 技术的创新和快速发展,市场上的电子设备出现了各种类型的充电接口和充电解决方案,然而由于充电接口规格的不统一、不兼容,一方面带来了大量的电子垃圾,造成了电子资源的浪费,另一方面也给消费者带
0评论2024-06-18114
广东药监局医疗器械常见问题答疑汇总
1、《企业落实医疗器械质量安全主体责任监督管理规定》包含哪些内容?答:《规定》共六章三十条,主要包括三方面内容:一是明确质量安全关键岗位要求。生产企业质量安全关键岗位人员包括企业法定代表人和主要负责人
0评论2024-03-05155