1.2 外省审评查验中心问卷调研
为学习外省审评查验中心在审评与注册核查衔接工作的先进经验,本课题发起了问卷调研。通过问卷收到了很多宝贵意见及经验做法。对于其中几项焦点问题的答复分析如下。
问题1:在注册审评过程中,会出现哪些审评与核查脱节的问题?
A. 审评员与检查员各司其职,对于产品的认识不统一
B.审评员仅关心检查结论,致使注册核查流于形式
C. 审评员通过检查报告无法了解产品及产品的生产体系
D. 检查员在检查过程中缺乏对产品本身特性的关注,难以发现产品的风险点
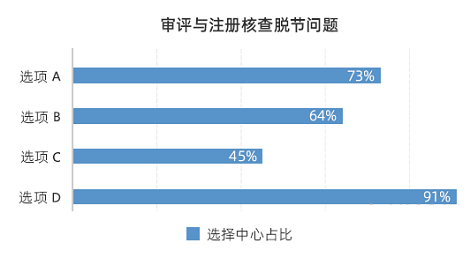
图2. 审评与注册核查脱节选项
由图2 可见,73%的中心认为存在“审评员与检查员各司其职,对于产品的认识不统一”问题,64%的中心认为存在“审评员仅关心检查结论,致使注册核查流于形式”问题,45%的中心认为存在“审评员通过检查报告无法了解产品及产品的生产体系”问题,91%的中心认为存在“检查员在检查过程中缺乏对产品本身特性的关注,难以发现产品的风险点”问题。可见审评与注册核查的脱节问题存在已久,情况复杂,选项A与选项B两条被选择最多,是最常见也最难解决的问题。问题既存在于审评员方面问题,也存在检查员方面的问题,须统筹考虑。
问题2. 审评员是否参与注册核查?
A. 审评员参与所有注册核查
B.审评员参与部分核查
C.审评员不参与核查
D. 其他
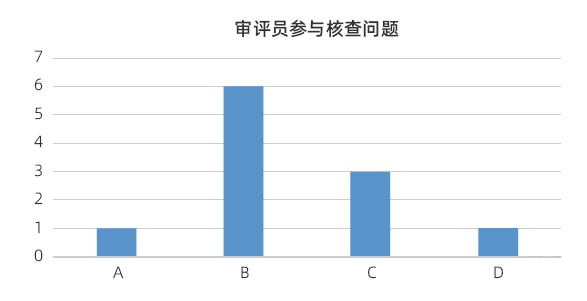
图3. 审评员参与核查问题
由图3 可见,此项回答中,选择A的有1 家(9%),选择B的有6 家(54%),选择C的有3 家(27%),选择D的有1(9%)家。各中心情况相差很大,核查任务的发起不统一,有的是检查科统一安排,有的是由省局适时启动。有的中心审评员参与部分核查,但不作为检查员身份参加,仅进行现场审评,同时了解产品体系中存在的问题及风险。有的中心审评员参与核查,但是不对应审评材料,主审人员很少参加自己审评的产品核查。
问题3:否认为本省监管部门应对医疗器械企业进行信用等级进行评定,依次作为企业免于或优化注册核查的依据?
此项回答中选择“是”的中心占总数的73%,选择“否”的占27%。大部分中心支持建立信用等级评定制度,但是要有严密的评定方案,评定的结果科学可靠,并且建议信用等级仅作为参考,不能作为唯一决定依据。且只有部分中心建立了信用等级评定制度。
问题4. 检查过程中是否对检查组成员有要求?
A. 有医疗器械检查经验即可
B.要有相关专业的学历背景
C.有核查医疗器械相关类别的经验
D. 有了解产品的审评人员参与

图4. 检查过程中是否对检查组成员的要求
由图4 可见此项回答大多为多选,现状如图所示,选择A、B、C、D的中心数占比分别为:36%、64%、73%、36%。可见大多数审评中心对检查员有一定的要求,“有核查医疗器械相关类别的经验”最重要,其次为“要有相关专业的学历背景”。
此外,所有中心均认为监管部门有必要针对体系核查中的免检、优化检查流程制定指导性文件,并进行细化。但是只有部分中心已经制定相应的指导性文件或政策。
由问卷调研的情况可以看出,首先,审评与注册核查存在脱节的问题,且原因是多样性的,情况较复杂,因此有必要充分明确审评和检查两个工作的关联性,识别其中风险,突出工作重点,避免审评员和检查员对申报产品接收信息不对称的风险。同时,应避免审评员和检查员在工作中职责不分,造成工作效率低下,重复劳动的风险。其次,审评员有必要适当参与注册核查,尤其鼓励审评员参与部分创新或复杂产品的现场检查,为检查组提示产品风险的同时也增加主审人员对产品的认知和理解,较好地衔接审评与注册核查。审评员也可在现场检查方案中注明审评中发现的问题,结合发补意见,带着问题进行现场检查,并在检查报告备注栏回复审评中需要关注的问题。再次,注册核查存在大量重复检查情况,即使是质量体系可以覆盖,样品真实性核查也需去现场,建议有规范性文件可以对此类情况进行规定,将减免核查分类分段细化,部分注册核查可通过资料审查的形式出具核查结果通知。或部分同类产品由审评中心判定免于注册核查。或实行企业信用评级,每年更新实时挂网,同时对于信用较好的企业可免于部分检查。











 苏公网安备32050802011615号
苏公网安备32050802011615号