关 键 词:医疗器械审评 注册核查 中医熏蒸治疗设备
医疗器械注册管理不仅是产品上市前的入口,更是医疗器械监督管理体系的源头,关系着公众健康和产业发展,因此将技术审评和质量管理体系联系起来具有重大的意义[1,2]。依据《医疗器械注册与备案管理办法》,医疗器械注册是指医疗器械注册申请人依照法定程序和要求提出医疗器械注册申请,药品监督管理部门依据法律法规,基于科学认知,进行安全性、有效性和质量可控性等审查,决定是否同意其申请的活动[3]。医疗器械注册质量管理体系核查是对注册人持续、稳定地提供符合设计要求和质量合格产品的系统核查[4]。
审评能力建设涉及诸多方面,主要包括人员和制度两大方面,前者主要包括人员能力的建设提升,后者主要包括审评质量管理体系、审评模式、考核机制、审评与注册核查衔接等,其中审评与注册核查的衔接相关问题一直以来被各审评查验机构关注,同时也是审评制度改革的着力点之一。
中医熏蒸治疗设备形式多样,涉及多个学科,临床应用广泛。中医治疗设备的生产企业同样也涉及不同规模、不同的研发实力,具有典型性,因此本课题调研过程中座谈走访了多家包括中医熏蒸治疗设备生产企业在内多家企业。本课题以查阅文献、座谈及调研为主,调研分为企业现场调研及问卷调研两大部分,问卷调研又分为问卷企业调研、外省审评查验中心调研。研究过程中外省审评查验中心及企业给出了大量有价值的经验做法及可贵建议。
1.研究过程
1.1 企业座谈、企业现场调研及问卷调研
本课题研究过程中邀请了部分企业进行了座谈,并选取较有代表性两家中医熏蒸仪生产企业进行现场走访调研,此次问卷调研共收到了18 家省内企业的反馈。详情如下。
1.1.1 座谈及现场调研
内容主要包括审评与注册核查衔接中存在的问题,涉及核查流程、核查内容、参与人员、审评与注册核查脱节、企业内部的注册与体系衔接等方面,各企业代表提出了意见以及建议。包括从流程上优化并联程序、在合适条件下减免部分检查、通过资料审核的方式代替现场审核,或现场审核减少部分内容等。企业同时建议审评员多参与现场核查,以加深对产品了解,提高审评质量,也可缓解审评与注册核查脱节的问题,使得审评与核查有机统一。企业还介绍了企业内部通过加强质量管理与注册申请部门的协作,从而加强注册申报与质量体系的有效结合。最后,企业还提出了存在的实际困难,如注册过程中如生产地址发生变化的情况,建议可以保留证据,提前核查。
1.1.2 问卷调研
为更广泛地收集企业的意见,更多角度地发掘问题,本课题开展了针对生产企业的问卷调查,共收到了18 家企业回复。现将主要问题分析如下。
问题1:请问审评一般在何时发起注册核查更加兼顾审评的质量与效率?
A. 在主审接受材料以后
B.主审一次发补以后
C.企业第一次补齐补正后
D. 生产许可增加产品时一起核查
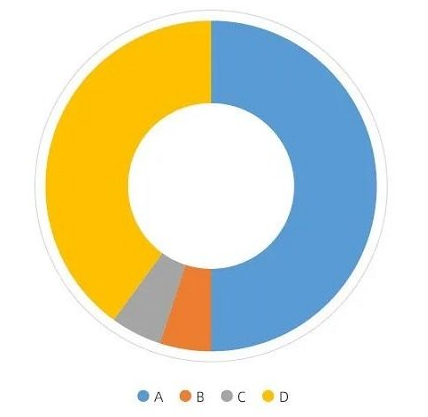
图1. 审评时发起注册核查时机
由图1 可见,选择“A. 在主审接受材料以后”及“D. 生产许可增加产品时一起核查”占比最多,分别为40%及50%。说明从企业角度这两个时期发起注册核查更合适。“主审接受材料后发起核查”,材料审评与注册核查为并行进行,节省了企业的时间成本;而“生产许可增加产品时一起核查”可以减少一次生产许可核查次数。此外,只有少数(5%)的企业认为串联的审评路径更方便高效,大多数(95%)的企业认为并联更高效。
问题2:在注册审评过程中,会出现哪些审评与核查脱节的问题?
收集汇总所有回答,总的来看,企业认为主要问题有:①审评员与检查员各司其职,对于产品的认识不统一;②审评员通过检查报告无法了解产品及产品的生产体系。为提高审评检查质量,大部分的企业认为审评员是有必要参与部分注册核查的,并且参与检查方案的制定。同时企业也要求检查人员不但要有医疗器械检查经验和相关专业的学历背景还要有核查医疗器械相关类别的经验。
通过与企业的座谈、走访企业、发放调研问卷等方式,发现企业对于审评审批制度改革持乐观及欢迎态度,提出了不少诚恳意见。比如在法规框架内,对于不同企业的不同产品,采取更加多样化的核查方式,提高审评检查的效率与质量;欢迎审评员参与现场核查,以更直观了解产品,提高审评质量;随着法规体系的不断更新,企业同时希望监管部门是应该针对体系核查中的免检/ 优化检查流程制定指导性文件,并进行细化;如注册过程中如生产地址发生变化,建议可以保留证据的方式,或者提前核查,解决现实中存在的困难。









 苏公网安备32050802011615号
苏公网安备32050802011615号